
89081 Ulm
Fotos
von Werner Hedlich eMail: 
89081 Ulm
Thema:
Chemie im Alltag – die Wunderwelt der
Kleinstkristalle!
Chemie begegnet uns überall im Alltag.
Ob im Haushalt, als Konservierungsstoffe,
Vitamine oder Arzneimittel; überall sind wir von Chemie umgeben. Doch wie
sehen diese Stoffe aus? Für das bloße Auge meist nur ein "weißes
Pulver", so zeigen sie uns erst im Polarisationsmikroskop ihre wahre Schönheit
voller bezaubernder Farben und Formen!
Kleinstkristalle im polarisierten Licht
Die Wunder des Mikrokosmos erscheinen uns im Mikroskop als eine exotische Welt
in unendlicher Vielfalt. Kein Kristall gleicht dem anderen in Form und Farbe.
Wie kommen solche Bilder zustande?
Kleinstkristalle entstehen durch Auskristallisieren von Lösungen oder Schmelzen
auf einem Objektträger, mit oder ohne Deckglas. Es handelt sich hierbei
um Salze von Säuren oder Laugen, aber auch um neutrale Stoffe. Da diese
Kristalle sehr klein sind, betrachten wir sie mit dem Mikroskop unter schwacher
bis mittlerer Vergrößerung. Doch das Bild mit "normaler"
Beleuchtung ist enttäuschend, denn diese Kristalle sind so dünn, dass
sie, von Ausnahmen abgesehen, keine Eigenfarbe zeigen. Erst bei Betrachtung
im polarisierten Licht zeigen sie ihre volle Schönheit! Bringen wir einen
doppelbrechenden Kristall unter das Polarisationsmikroskop, so wird das aus
dem Polarisator austretende, nur in einer Ebene schwingende Licht den Kristall
durchdringen. Bei Betrachtung durch den gekreuzten Analysator erscheint er hell
auf dunklem Untergrund. Durch verschiedene Ausbreitungsgeschwindigkeiten des
ordentlichen und des außerordentlichen Lichtstrahls im Kristall entstehen
nach Passieren des Analysators lebhafte Farben (Interferenz)!
Das optische Verhalten der Kristalle führt zu einer Unterteilung in optisch
isotrope und anisotrope Kristalle.
Isotrope Kristalle besitzen in ihrer räumlichen Struktur
drei gleich lange Achsen, die senkrecht aufeinander stehen. Die Lichtbrechung
ist in allen Richtungen gleich groß. Hierzu zählen die Kristalle
des kubischen Systems.
Anisotrope Kristalle weisen in ihrem Strukturaufbau drei unterschiedlich
lange Achsen auf, welche senkrecht aufeinander stehen. Daher ist die Lichtbrechung
in allen Richtungen unterschiedlich. Es tritt das Phänomen der Doppelbrechung
auf. Alle nichtkubischen Kristalle sind anisotrop und lassen sich in zwei Gruppen
aufteilen.
1. Einachsige Strukturen
2. Zweiachsige Strukturen
Doppelbrechung: Ein durch einen doppeltbrechenden Kristall betrachtetes Bild erscheint doppelt, da der einfallende Lichtstrahl in zwei Strahlen zerlegt wird. Es entsteht ein ordentlicher Strahl, der dem Brechungsgesetz folgt, und ein außerordentlicher. Bei den meisten Mineralen ist die Doppelbrechung so gering, dass sie nur mit dem Polarisationsmikroskop nachgewiesen werden kann.
Da einachsige Strukturen (isotrope) keine Doppelbrechung aufweisen, entstehen
im Polarisationsmikroskop keine farbigen Bilder, zum Beispiel bei Natriumclorid
(Kochsalz).
©COPYRIGHT:
Alle Uhrheber- und Verwendungsrechte liegen bei den Bildautoren. Eine Verwendung der auf dieser Webseite gezeigten Bilder ist nur mit schriftlicher Zusage des Bildautors möglich.
Klicken Sie auf ein Bild, um es zu vergrößern.
| Glutaminsäure | Menthol |
 |
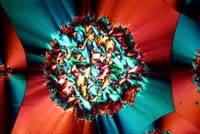 |
| Salicylsäure | Acetylsalizylsäure (Aspirin) |
 |
_wh_72_kl.jpg) |
| Phtalsäure | Vitamin B6 |
 |
 |
| Vitamin B1 | Harnstoff |
 |
 |
| Natriumbicarbonat | Sorbinsäure |
 |
 |
| Beispiele für gemischte | Substanzen |
 |
 |
 |
 |
 |
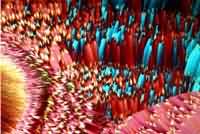 |
 |
 |
 |
 |